2014年ASCO的全体大会公布了结直肠癌的重磅研究——CALGB80405,该研究是第一项在KRAS野生型mCRC初治患者中,以OS为主要研究终点,头对头比较“化疗+西妥昔单抗”与“化疗+贝伐珠单抗”的Ⅲ期临床研究。陈功教授对此研究进行了详细点评,详见下文。
【ASCO2014】陈功教授:CALGB80405研究给我们带来哪些新启示?
作者 中山大学附属肿瘤医院 陈功
6月1日下午,2014年ASCO年会现场,结直肠癌领域唯一入围的全体大会报告研究――CALGB80405,由其主要研究者、美国加州大学洛杉矶分校弗农(Venook)教授公布了结果,可谓万众瞩目。为何这项试验这么引人关注?这得从背景说起,从去年ASCO最热的研究FIRE-3说起。
背景:mCRC一线靶向治疗选择
约10年前,一线治疗中5-氟尿嘧啶(5-FU)/亚叶酸钙(LV)+伊立替康(FOL FIRI)与5-FU/LV+奥沙利铂(FOLFOX)孰优孰劣曾面临同样争论,后来经过V308等头对头研究得出两方案疗效一样的结论,才平息了争论。如今又面临KRAS(RAS)野生型mCRC抗表皮生长因子受体(EGFR)治疗[西妥昔单抗(Cet)、帕尼单抗]和抗血管内皮生长因子(VEGF)治疗[贝伐珠单抗(Bev)]孰优孰劣的问题。2013年ASCO年会公布了欧洲牵头的FIRE-3研究,显示初始治疗选择FOL FIRI联合西妥昔单抗优于联合贝伐珠单抗。时隔一年,由美国学者牵头的CALGB80405研究终于公布结果,该结果会给转移性结直肠癌(mCRC)初始靶向选择带来哪些新启示?让我们全方位逐一解析。
研究简介及结果
研究设计
CALGB80405研究是第一项在KRAS野生型mCRC初治患者中,以OS为主要研究终点、头对头比较“化疗+Cet”与“化疗+Bev”的多中心、开放、随机对照Ⅲ期临床研究,于2005年启动。来自北美的400多家中心参与了研究。研究设计为优效性,其假说是在化疗+Cet或化疗+Bev的治疗模式中,其中一组的疗效优于另一组,总生存(OS)将从22个月(对照组)提高5.5个月,到达27.5个月(试验组),在90%检验效能下达到优效性P<0.05的风险比(HR)为0.8;统计学H0假设是化疗+Cet组疗效等于化疗+Bev组。
研究共纳入1137例KRAS12/13密码子野生型mCRC初治患者,其中578例进入化疗+Cet组,559例进入化疗+Bev组。研究中,患者选用哪种化疗方案由临床医生决定,结果73%的患者接受FOLFOX方案,27%的患者接受FOLFIRI方案,但在Cet和Bev两组间是均衡的。其主要研究终点是OS,次要终点包括客观缓解率(ORR)、无进展生存(PFS)及化疗与靶向药物之间的交互作用等。
研究结果
本次大会报告的是第11次中期分析结果,主要生存数据显示Bev组和Cet组疗效相同:OS分别为29.0个月和29.9个月,HR=0.925(0.78~1.09),P=0.34;PFS分别为10.8个月和10.4个月,HR=1.04,P=0.55。因此,从主要生存终点来看,80405试验并未达到,两组的OS均为29个月左右,统计学上不能拒绝H0假说,没有足够证据表明其中一种治疗模式优于另一种,也即可认为化疗+Cet的疗效等于化疗+Bev。
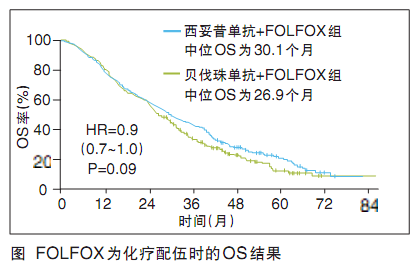
但该研究的亚组生存数据却出人意料。FOLFOX为化疗配伍时,Bev组的OS为26.9个月,Cet组为30.1个月,Cet组延长了3.2个月,HR=0.9,P=0.09(图);FOLFIRI为化疗配伍时,Bev组的OS为33.4个月,Cet组为28.9个月,Bev组延长了4.5个月,HR=1.2,P=0.28;目前的结果仅是针对KRAS12/13密码子野生型的患者,针对RAS的分析正在进行中,预计2014年欧洲肿瘤内科学会(ES MO)年会揭晓;而该研究的其他很多结果,包括ORR、转移瘤手术切除、后续治疗细节等情况均未公布,值得拭目以待。
资讯详情:【ASCO2014】Bev与Cet一线治疗mCRC的疗效比较
研究启示
关于研究设计及信息披露的局限性
首先,CALGB80405研究的优效性设计以OS延长达5.5个月(对照组22.0个月,试验组27.5个月)以上作为达到主要终点,这对于2005年发起、2009年对研究设计进行调整的时间点来说,这样的研究设计和统计学假设似乎有些过于乐观。回顾结直肠癌化疗及靶向药物发展史,Bev联合化疗的AVF2107g研究(2004年)显示的OS差异为4.7个月,Cet联合化疗的CRYS TAL研究(2008年)显示针对KRAS野生型患者的OS差异为3.5个月(Cet联合FOLFIRI组为23.5个月),即便在研究者都未预料到的FIRE-3研究中(2013年),Cet+FOLFIRI较Bev+FOLFIRI使KRAS野生患者的OS改善也仅3.7个月。因此,CALGB80405试验当时将OS延长5.5个月设定为Cet和Bev两种靶向治疗具有优效性的统计学检验界值,在当时尚不知道KRAS、RAS故事的情况下,设计的确过于乐观,几乎就是个不可能完成的任务。
另外,研究中就患者基线水平公布的信息非常有限,仅公布了年龄、性别、原发瘤存在、姑息治疗意向及化疗配伍比例等,因此难以完全清晰判断研究中是否存在患者选择的偏倚。
最后,此次报告只知道88%左右的患者接受了二线及后续治疗,未报告更多的细节情况,难以判断后续治疗对OS的影响,所以需要期待进一步的二线治疗的详细分析。
关于靶向药物的化疗配伍问题探讨
CALGB80405研究中,与靶向药物配伍的化疗方案基于研究者的选择,结果仅27%的患者(302例)接受FOLFIRI方案,相较于FIRE3研究而言样本量较小。结果是Cet组OS较Bev组缩短4.5个月,与FIRE-3结果完全相反。FIRE-3研究中Cet组的OS较Bev组显著延长(KRAS野生群体延长3.7个月,RAS野生群体延长7.5个月)。所以,CALGB80405研究在FOLFIRI组出现的结果,出乎意料,令人费解,除了样本量外,也许需更多数据来分析,如一线中位治疗时间、二线治疗方案、更多的患者基线数据等。虽然FOLFIRI方案在美国也是一线标准方案,但美国医生更普遍使用FOLFOX方案,CAL GB80405研究中73%的患者接受了FOLFOX方案。
关于Cet与含奥沙利铂化疗方案的配伍问题一直存在争议,主要是因为2012年美国国立综合癌症网络(NCCN)指南基于COIN和NORDICⅦ研究结果在一线推荐方案中删除了FOLFOX联合Cet方案,引起业界哗然并一直在争议,而ESMO结直肠癌诊疗共识仍推荐FOLFOX联合Cet方案。实际上,所有研究的综合分析显示,影响Cet与奥沙利铂疗效的可能是方案中5-FU的给药方式,即Cet只适合与静脉输注的5-FU联合(FOLFOX),而不适合与推注(FLOX)或口服(XELOX)给药的氟尿嘧啶联合。当年COIN的亚组分析就显示,对于KRAS野生型mCRC患者,Cet联合FOLFOX时有PFS显著获益(P=0.037)。从CALGB80405结果来看,情况也类似,FOLFOX+Cet并不比FOLFOX+Bev差,数值上前者还有3.2个月的优势(图),提示前者有优效的趋势;且基于以前研究中全RAS的数据分析,KRAS野生型中约15%的RAS突变者,FOLFOX+Cet还可能带来生存受损,去除这个影响因素后,差距会不会进一步扩大,看来是很有可能。而NCCN可不可能在未来的指南修订中再次为FOLFOX+Cet平反,重新推荐呢?研究者在本次报告中也提及,该结果足以改变NCCN指南中FOLFOX联合Cet的推荐。相信在ESMO上进一步揭示的RAS结果会为临床带来更充足的证据。
关于靶向药物生物标志物RAS的探讨
继KRAS基因之后,近年的研究显示RAS基因状态对EGFR抑制剂的选择具有更精准的指导意义。KRAS野生型是指KRAS外显子2无突变,在mCRC中约占60%;RAS野生型定义更为严格,是指KRAS和NRAS外显子2、3、4均无突变,在mCRC中约占50%。
新近研究相继证实RAS野生型患者初始接受化疗+抗EGFR单抗可获得更显著的生存获益。PRIME和PEAK研究表明,与KRAS野生型相比,RAS野生型患者更能从化疗联合帕尼单抗治疗中生存获益。FIRE-3研究显示,与FOLFIRI+Bev相比,FOL FIRI+Cet带来的OS获益从KRAS野生型患者的3.7个月延长至RAS野生型患者的7.5个月。在本届ASCO年会上,CRYSTAL研究基于RAS分析的最新结果也显示,与FOLFIRI相比,西妥昔单抗+FOLFIRI带来的OS获益从KRAS野生型患者的3.5个月(23.5个月对20个月)延长至RAS野生型患者的8.2个月(28.4个月对20.2个月,P=0.0024)。针对CALGB80405研究的RAS数据会进一步阐明西妥昔单抗在RAS野生型患者中的治疗优势。正如塔韦内罗(Tabernero)教授在对CALGB80405试验进行讨论时分析的那样,基于其他研究结果,KRAS野生型患者中其他RAS突变的几率约15%,剔除这些突变病例后,全RAS数据下,该试验的HR可能会从目前的0.92下降到0.85~0.87左右,而这是有可能改变结果的。让我们拭目以待吧。
后记
CALGB80405研究是继FIRE-3研究之后,第二项在KRAS野生型初治mCRC患者中进行的西妥昔单抗对比贝伐珠单抗联合化疗的头对头比较研究。尽管试验结果整体是阴性,现有结论认为在上述人群中并未观察到两种靶向治疗有差异,都可作为一线治疗选择。但研究的亚组信息为初始靶向药物选择抗EGFR还是抗VEGF在某种意义上提供了参考信息,而该研究尚有很多信息尚未披露,包括RAS分析数据、二线及后续治疗、外科切除、ORR等等,这些信息的逐步公布,将会有助于我们进一步探索这个问题,指导临床,尤其是CALGB80405研究的RAS扩展分析,期待其会给mCRC患者一线靶向药物选择提供更多证据。毕竟,未来的方向是甄别哪些群体更适合接受哪一种治疗。基于分子标志物的有效人群富集才是未来发展的方向,才能真正做到“合适患者接受合适治疗”的真正个体化医疗。
会议专题》》》2014年ASCO年会专题报道
