医脉通编译整理,转载请务必注明出处。
美国食品药物管理局于4月24日宣布批准ramucirumab与FOLFIRI化疗联合应用于治疗某些转移性结直肠癌患者。医脉通对此进行了报道。
ramucirumab(Cyramza,礼来)目前被批准用于治疗在含贝伐单抗方案(阿瓦斯丁, Genentech)、奥沙利铂和氟尿嘧啶一线治疗后出现疾病进展的转移性结直肠癌。
美国食品药品管理局的此次批准是基于一项多国参与的随机,双盲试验结果。该试验共入组1072例转移性结直肠癌患者(中位年龄62岁,57%为男性),这些患者在含bevacizumab、奥沙利铂和氟尿嘧啶联合治疗期间或停药6个月内发生了疾病进展。
研究详情:二线Ramucirumab/FOLFIRI提高转移性CRC生存期
研究人员按1:1的比例,随机将患者分为接受FOLFIRI加上安慰剂组,或FOLFIRI+ramucirumab组。患者的治疗按其所处的地理区域,KRAS基因状态和一线治疗开始到疾病的进展时间(少于6个月,6个月以上)来进行亚组分层。
两组的化疗周期为每2周1次。试验组患者接受8 mg/kg ramucirumab静脉注射,每2周1次,直至疾病进展或出现不可接受的毒性。
该研究的主要终点是OS。
与FOLFIRI加安慰剂的患者相比,FOLFIRI加ramucirumab患者的OS表现出显著改善,(HR = 0.85; 95%CI,0.73-0.98)。ramucirumab组中位OS为13.3个月,而安慰剂组为11.7个月。
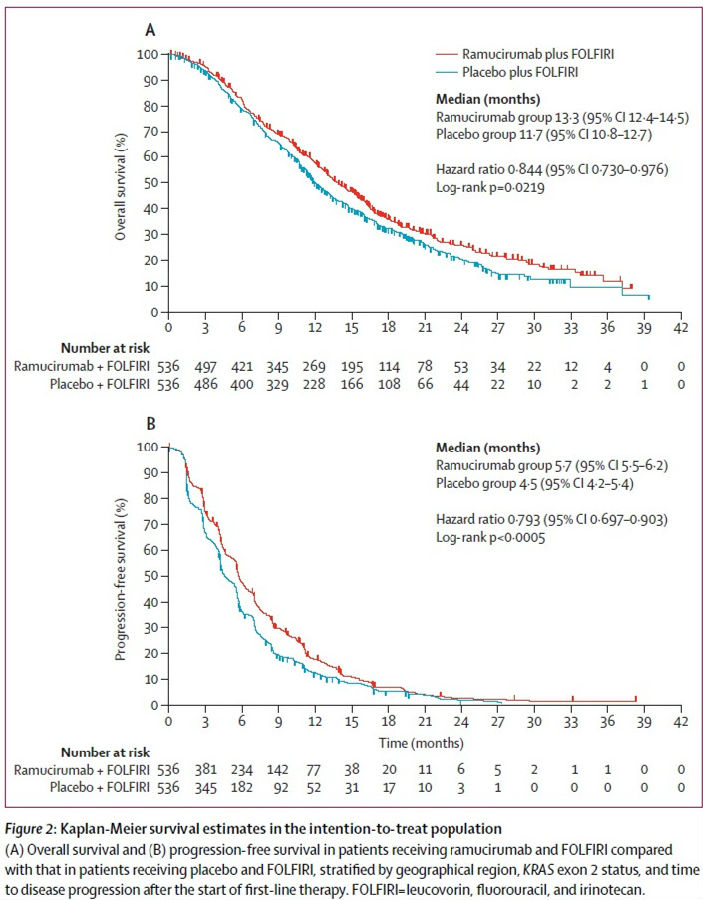
FOLFIRI加ramucirumab组的PFS也有显著的改善(HR = 0.79; 95%CI,0.7-0.9).ramucirumab组中位PFS为5.7个月,而安慰剂组为4.5个月。
该药物的安全数据与之前观察到的安全性数据一致,甲状腺监测证实2.6%患者出现甲状腺功能减退。
医脉通编译自:FDA approves Cyramza for mCRC, Healio, April 24, 2015
