蒽环类药物治疗血液恶性肿瘤和实体瘤疗效确切,但其存在治疗相关心脏毒性,表现为进展性与不可逆性,且首次使用就可能对心脏造成损伤。在使用蒽环类药物时,早期监测和提前预防心脏毒性显得尤为重要。

马军,哈尔滨血液病肿瘤研究所所长,主任医师,教授。中国临床肿瘤学会(CSCO)指导委员会主任委员。
当前治疗血液肿瘤和实体肿瘤的蒽环类药物包括柔红霉素、去甲氧柔红霉素、盐酸多柔比星、表柔比星、阿柔比星、米托蒽醌、吡喃多柔比星、脂质体多柔比星、脂质体柔红霉素、脂质体去甲氧柔红霉素。
蒽环类药物是血液肿瘤和实体肿瘤(急性髓细胞白血病、急性淋巴细胞白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤、乳腺癌、胃癌、骨肉瘤、软组织肉瘤、卵巢癌等)的基石类药物。首先,在复发转移性乳腺癌化疗中,中国抗癌协会乳腺癌专业委员会及美国国立综合癌症网络(NCCN)指南均肯定了蒽环类药物的地位和作用,推荐的化疗药物如下。①蒽环类:如多柔比星、表柔比星、聚乙二醇化脂质体多柔比星。②紫杉类:如紫杉醇、多西他赛、白蛋白结合型紫杉醇。③抗代谢药:如卡培他滨、吉西他滨。④非紫杉醇类微血管形成抑制剂:如长春瑞滨。其次,蒽环类药物在血液恶性肿瘤治疗中也彰显了其基石地位。①非霍奇金淋巴瘤:多柔比星、表柔比星、脂质体多柔比星、去甲氧柔红霉素、米托蒽醌。②霍奇金淋巴瘤:多柔比星、表柔比星、脂质体多柔比星。③急性髓细胞白血病:多柔比星、柔红霉素、去甲氧柔红霉素、米托蒽醌、阿柔比星。④急性淋巴细胞白血病:多柔比星、柔红霉素。
早期监测并提前预防蒽环类药物心脏毒性需要清楚地了解其相关心脏毒性的分类、特点、作用机理及如何监测和预防,从而使患者有更好的获益。
蒽环类药物相关心脏毒性分类
急性心脏毒性 在给药后的几小时或几天内发生,常表现为心内传导紊乱和心律失常,极少数表现急性左心衰。
慢性心脏毒性 在化疗的1年内发生,表现为左心室功能障碍,最终可导致心衰。
迟发性心脏毒性 在化疗后数年发生,可表现心衰、心肌病及心律失常等。
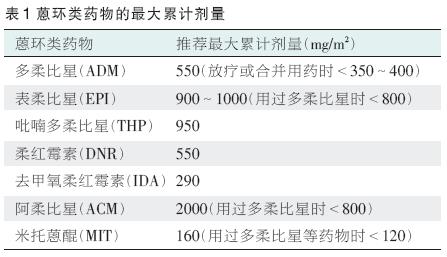
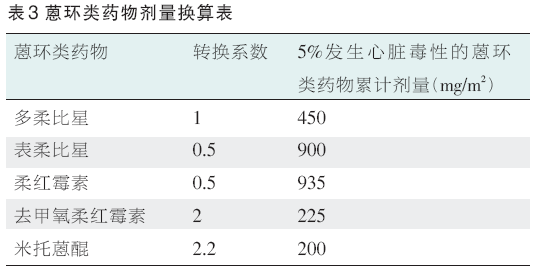
蒽环类药物的慢性及迟发性心脏毒性与其累计剂量相关,因此限制其累计剂量可以降低心脏毒性的发生率。蒽环类药物的最大累计剂量见表1,多柔比星累计剂量与心衰发生的关系见表2,蒽环类药物间剂量换算见表3。

蒽环类药物心脏毒性特点
蒽环类药物心脏毒性具有以下特点。①蒽环类药物的慢性及迟发性心脏毒性与其累计剂量呈正相关;②低剂量蒽环类药物也可能引起心脏毒性;③蒽环类药物对心脏的器质性损害从首次应用时就有可能出现。
蒽环类药物治疗后的前几年中,超过50%的患者发生心脏后负荷增加或收缩能力下降。大多数患者在蒽环类给药后很快发生心脏损害,而且随着时间的延长损害越明显,呈进展性与不可逆性。并且,蒽环类药物没有绝对的安全剂量,低剂量蒽环类药物也可能引起心脏毒性,可能是因为个体差异,患者体内代谢蒽环类药物相关基因的差异性导致其对蒽环类药物的易感性不同。
蒽环类药物心脏毒性的发生机理
蒽环类药物心脏毒性的机理较复杂,尚未完全明确。有研究认为可能是自由基攻击,导致细胞线粒体损伤,使得ATP、GTP生成减少,干扰钙离子的转运,膜结构的改变,酶活性的改变等。也有研究显示,蒽环类药物诱导的心脏毒性主要的作用机制是形成含蒽环类药物-三价铁复合物的自由基。心脏是人体最大的耗能器官,线粒体是能量的主要来源,因此心脏的线粒体非常丰富,是产生活性氧簇(ROS)的根源,且心脏比其他组织缺乏清除自由基的酶(超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶),其抗氧化作用较弱,因而更易产生心脏毒性。
蒽环类药物心脏毒性诊疗概要
蒽环类药物心脏毒性诊疗主要包括以下方面。①通过心脏不良事件评定标准(CTCAE4.0)及心内膜心肌活检评分(EMB)进行诊断判定,EMB是公认的评估蒽环类药物心脏毒性最为敏感、最特异的方法;②进行必要监测与检查,如超声心动图、肌钙蛋白、心电图、心内膜心肌活检等;③预防或减少蒽环类药物心脏毒性事件的发生以及对其进行治疗。
蒽环类药物心脏毒性的诊断
药物心脏毒性是指具有下面的1项或多项。①左心室射血分数(LVEF)降低的心肌病,表现为整体功能降低或室间隔运动明显降低;②充血性心衰(CHF)相关的症状;③CHF相关的体征,如第3心音奔马律、心动过速,或两者都有;④LVEF较基线降低至少5%至绝对值<55%,伴随CHF的症状或体征;或LVEF降低至少10%至绝对值<55%,未伴有症状或体征。
蒽环类药物心脏毒性的监测与检查
蒽环类药物心脏毒性病理学改变如下。①光镜:心肌水肿,细胞消失,间质纤维化,局部~广泛的心肌细胞肌浆网扩张。②电镜:心肌纤维束缺失,Z线断裂,纤维溶解,线粒体肿胀空泡变,肌浆网水肿断裂,心肌细胞空泡化。
蒽环类药物心脏毒性常用的监测方法包括LVEF和左室缩短轴分数(FS),可区分危险人群,对预防心衰有重要意义。然而,LVEF常会低估心脏损伤,LVEF正常者也可有亚临床的心功能损伤。因此,LVEF对早期的亚临床心脏疾病的监测并不敏感。
应用蒽环类药物化疗患者的生物标志物心肌肌钙蛋白(cTn)T/TnI水平显著增高,且与心脏舒张功能不全相关。在出现明显的LVEF变化前,cTnT/TnI即可监测到多柔比星等蒽环类药物导致的早期心脏毒性。
此外,对于化疗、靶向药物和放疗导致的心血管毒性,欧洲肿瘤内科学会(ESMO)临床实践指南指出,对于辅助治疗给予蒽环类药物和(或)曲妥珠单抗的患者要进行心脏监测,对心功能进行连续监测,包括基线值及治疗后第3、6、9个月,观察到12个月甚至更长时间。治疗期间或治疗后如有临床指征,应重复监测。
美国心脏学会(AHA)推荐,对患者给予蒽环类药物治疗时,要密切监测心功能,LVEF降低超过10%时,建议选择更灵敏的方法进行监测,例如,动态监测cTn等。
蒽环类药物心脏毒性预防与治疗
蒽环类药物心脏毒性的高危患者包括:有高血压病史者、原有心血管疾病者、先前接受过蒽环类药物化疗或者放射治疗、年轻患者、年龄>65岁成人、非-美洲后裔、女性、21-三体综合征患者等。
减少蒽环类药物心脏毒性的措施如下:①限制蒽环类药物累计剂量;②改变给药方法;③使用脂质体蒽环类药物。
对于化疗、靶向药物和放疗导致的心血管毒性,ESMO临床实践指南指出,为减少心脏毒性,应考虑并计划在所有心脏毒性高危患者中使用脂质体多柔比星和使用合适的心脏保护药物[如右丙亚胺、受体阻滞剂、血管紧张素转化酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)]。
关于心脏保护药物的8个随机对照研究发现,除右丙亚胺,其他心脏保护药物对蒽环类药物所致心脏毒性都无明显的保护作用。右丙亚胺可有效预防蒽环类药物心脏毒性且不影响其疗效。2008-2014年,右丙亚胺进入《中国蒽环类药物心脏毒性防治指南》。
右丙亚胺的使用方法及注意事项如下。①使用时间:首次使用蒽环类药物应联合应用右丙亚胺,可以有效预防蒽环类药物心脏毒性。②使用剂量:右丙亚胺与蒽环类药物的剂量比为10~20︰1(推荐右丙亚胺︰ADM=20︰1,右丙亚胺︰DNR=20︰1,右丙亚胺︰EPI=10︰1,右丙亚胺︰MIT=50︰1,右丙亚胺︰脂质体多柔比星=10︰1)。③使用方法:用专用溶媒乳酸钠配置后,再用0.9%氯化钠或5%葡萄糖注射液稀释至200 ml,快速静脉输注,30分钟内滴完,滴完后即刻给予蒽环类药物。
心脏毒性的治疗:①对症处理;②心衰时应常规联用3种药物——ACEI、ARB和β受体阻滞剂;③心脏保护剂。
小结
蒽环类药物是有效的抗肿瘤药物,但其导致的严重心脏毒性影响了其在临床上的广泛应用。蒽环类药物的心脏毒性,除了患者和药物本身因素以外,也与临床医生重视不够有关。目前针对心脏毒性的肿瘤学临床试验,很少关注无症状的左室功能不全,即使有心衰表现,也常被忽视。监测、防治由蒽环类药物所致的心脏毒性,需要肿瘤科和心血管科医生的密切合作。应客观认识蒽环类药物化疗的利与弊,预防心脏毒性。治疗前应充分评估治疗的获益及潜在风险,全面了解患者的器官功能、肿瘤情况,了解药物的作用机制、代谢及相互作用、毒副反应,并与患者充分沟通,从而权衡利弊,尽量降低心衰的风险。治疗期间及治疗后应密切监测心功能,及早预防蒽环类心脏毒性。
(文章来源于《临床肿瘤学论坛》)
