2017年7月6日至7月9日,第十一届中国肿瘤内科大会(CSMO2017)在国家会议中心举行。在7月8日的肿瘤治疗专场中,来自沈阳军区总医院全军肿瘤诊治中心的谢晓冬教授以“靶向药物致心脏毒性的研究现状及最新进展”为题,做出精彩汇报,以下是详细内容。

谢晓冬教授
沈阳军区总院全军肿瘤中心主任
主任医师 博士生导师
中国抗癌协会理事
中国临床肿瘤学会CSCO理事
CSCO抗肿瘤药物安全管理专家委员会专家
CSCO肾癌专家委员会专家
中国抗癌协会肿瘤标志专委会副主委
全军肿瘤学专委会副主委
中央军委保健专家
肿瘤—心脏病学发展史
谢晓冬教授首先介绍了国内外肿瘤-心脏病学的发展史。
2000年,MD Anderson癌症中心率先开展了心脏-肿瘤学项目,现已开展了5次心脏-肿瘤学术年会;
2009年,北美国际心脏-肿瘤学会(ICOS)成立;
2011年,加拿大心脏肿瘤网络(CCON)建立,囊括北美、加拿大、欧洲和波兰4个分支,包括60%的心脏科医生和40%的肿瘤科医生,会员共计2000余名;
2016年以来,我国于大连、哈尔滨等地相继多次召开了肿瘤心脏病学研讨会。
据2015年《全球疾病负担研究报告》显示,全球71.3%的死亡案例是由非传染性疾病造成,其中肿瘤、心血管疾病、精神异常及滥用药物是非传染性疾病中的重要原因。

肿瘤和心血管疾病都具有基数大和增长快的特点。并且,在肿瘤的诊治过程中,出现心血管系统相关并发症的患者不在少数,肿瘤心脏病学成为最近研究的热点。
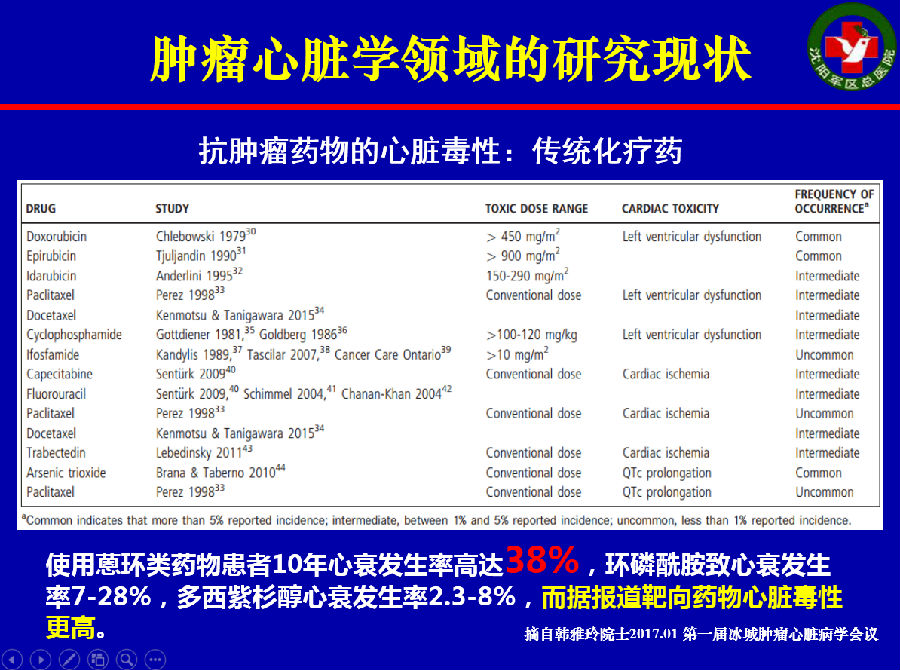
早在七十年代,就有蒽环类药物导致心肌病和心衰的相关研究。这也导致了在肿瘤治疗过程中,临床医生做出了如下的改变:
◆降低了蒽环类药物使用剂量;
◆监测基线左室收缩功能;
◆在高剂量治疗中动态监测左室射血分数;
◆应用平衡法放射性核素心血管造影(MUGA),根据心动能调整药物剂量。
但是,即便如此,使用蒽环类药物患者的10年心衰发生率仍高达38%,环磷酰胺导致的心衰发生率为7-28%,靶向药物的心脏毒性也更加不容忽视。
肿瘤分子靶向药物的概况及现状
最近10几年,抗肿瘤靶向药物蓬勃发展,新兴的药物数不胜数。早在1997年,利妥昔单抗的出现给淋巴瘤患者带来了希望;1998年,曲妥珠单抗也被FDA批准上市。
随后,吉非替尼、贝伐珠单抗、索法非尼、克唑替尼、Kacyla等等药物相继问世,给恶性肿瘤患者带来了更为优化的选择。

在这些精准医学治疗药物中,已有很多在中国获批,广泛在我国临床诊疗实践中使用。
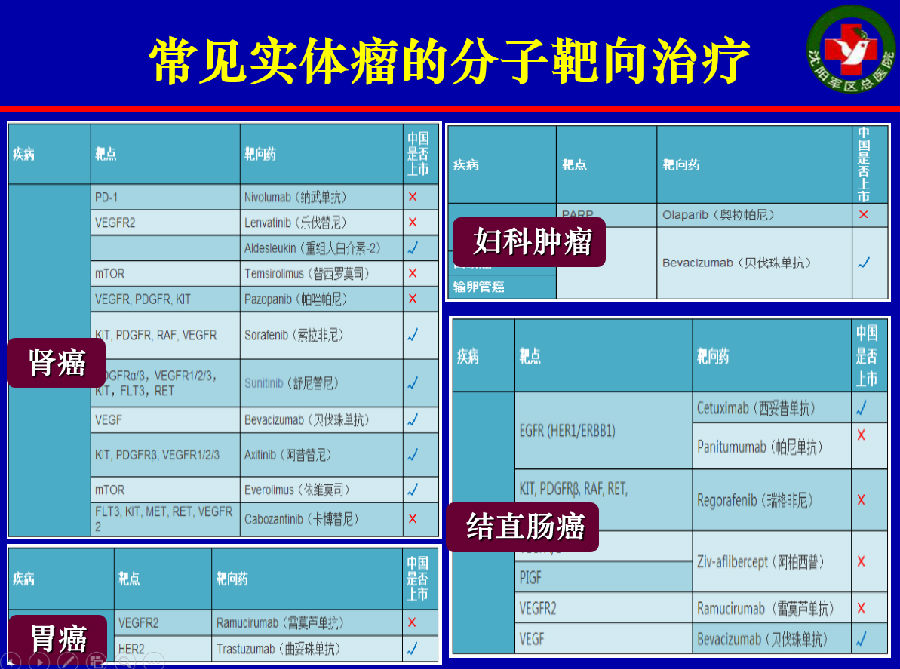
但是,在靶向药物给患者带来更好的疗效的同时,安全性的问题不容忽视。大体来讲,靶向药物具有特异性的治疗毒性。最常见的即为皮疹、腹泻、乏力,以及心脏毒性。
心血管毒性的发生率及发生机制
那么,靶向药物治疗相关心脏毒性的发生机制是什么呢?2016年8月27日,欧洲心脏病学会年会(ESC 2016)发布了《2016年欧洲癌症治疗与心血管毒性实用指南》。
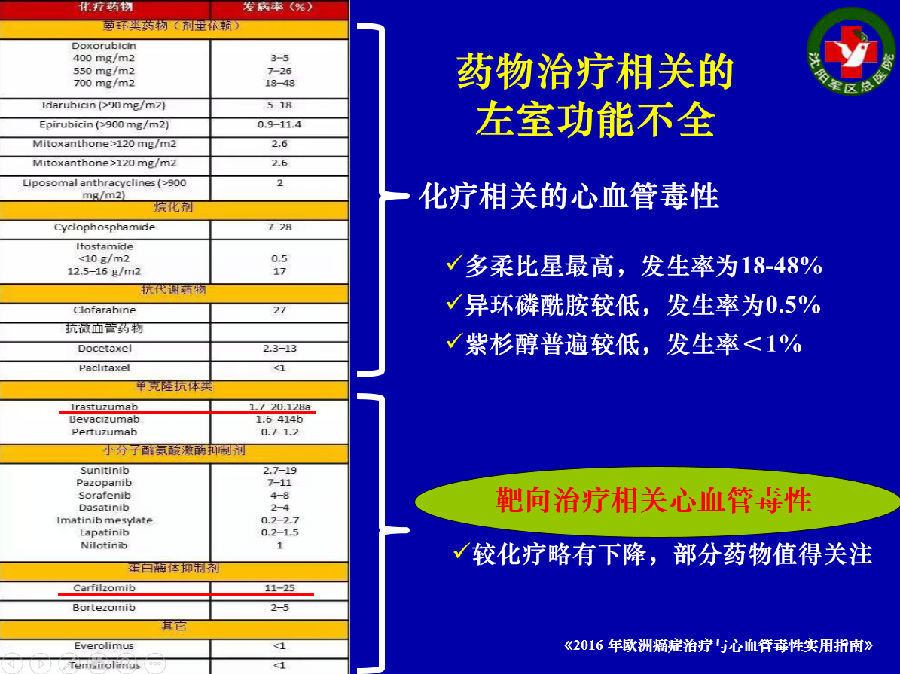
《指南》中表明,化疗相关的左室功能不全的发生率最高的蒽环类。靶向药物治疗相关心血管毒性较化疗略低,但是有部分药物值得关注。
曲妥珠单抗
靶向治疗引发心脏毒性也有不少案例。Calleja等统计了30例接受曲妥珠单抗治疗的Her-2阳性乳腺癌患者,她们在治疗过程中接受了心脏超声的监测。
结果表明,在接受曲妥珠单抗治疗的乳腺癌患者中,出现心功能不全者十分常见。
Bayer等的病例报告中,接受紫杉醇联合曲妥珠单抗治疗也会出现右心衰和右室功能不全。

JCO中的研究表明,曲妥珠单抗与蒽环类药物联合使用,心血管毒副作用的最大发生率高达27%,需要引起足够重视。
曲妥珠单抗导致的心脏毒性可能的发生机制为:Her-2在心肌细胞中表达,起到维持心肌细胞功能,修复心肌细胞损伤等重要作用。
曲妥珠单抗与心肌细胞的Her-2受体结合,可以导致Bcl-xL和Bcl-sL失衡激活线粒体凋亡途径,使心肌细胞凋亡。
所以,抗Her-2药物导致的心血管毒性(Ⅱ型)与化疗引起的心脏毒性(Ⅰ型)不同(见下图)。

但是,2016年由台湾研究团队发表在JAMA Oncology上的队列研究表明,台湾女性患者曲妥珠单抗治疗相关心衰或心肌病的发生率较既往研究低5倍。
到底是由于年龄、蒽环类药物暴露时间及并发症类型不同导致该结果的差异,还是亚裔人对曲妥珠单抗心脏毒性耐受性较好,尚需进一步研究。
舒尼替尼
Lancet Oncology上发表的一项荟萃分析表明,舒尼替尼治疗晚期转移性结直肠癌的全级别或3度以上高血压的发生率分别为21.6%和6.8%。
Acta Oncol.上的研究表明,舒尼替尼所致的全级别或3度以上高血压的发生率分别为23.4%和5.7%。
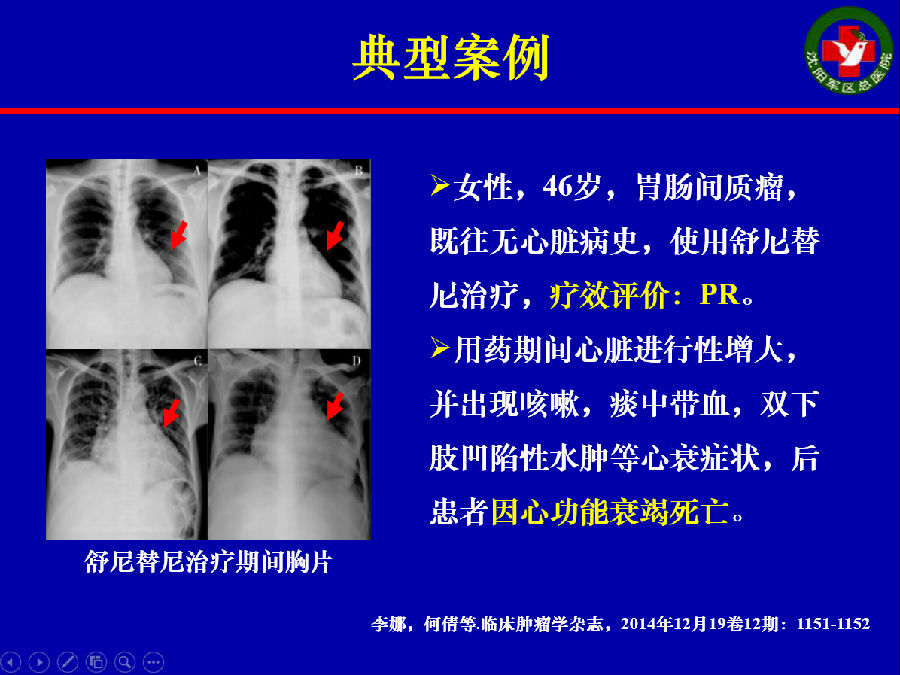
应用舒尼替尼治疗的胃肠间质瘤患者也有因心脏毒性死亡的病例。
Lancet上发表的舒尼替尼治疗无心脏病的胃肠间质瘤患者的研究表明,心脏不良事件的发生率约为11%,其中 3度以上的充血性心力衰竭发生率为8%。
Clin Transil Sci的研究表明,舒尼替尼导致心脏毒性的相关机制可能为:
直接抑制心肌细胞内AMP活化蛋白激酶,造成线粒体能量合成障碍,引起心肌细胞损伤;
TKI介导的永久性抑制VEGF信号可能会削弱正常的血管生成反应,使血管生长速度慢于心肌生长速度,导致心肌收缩障碍和心功能衰竭。
2008年ASCO的泌尿生殖专场上,Telii教授汇报中指出,48例应用舒尼替尼的患者中有12.5%出现3-4度的心力衰竭。
贝伐珠单抗
2008年贝伐珠单抗的处方信息中表明,心血管不良事件(心肌梗塞、心绞痛等)的发生率为4.4%。
在纳入7项研究,1850例患者的Meta分析显示,使用贝伐珠单抗治疗的低剂量组(3,5,7.5mg/kg)高血压发生率为2.7-32%。高剂量组(10或15mg/kg)发生率为17.6-36%。
贝伐珠单抗导致心血管毒性的可能机制为:
抑制VEGF信号转导,从而抑制VEGF受体下游PI3K、MAPK信号级联对内皮型一氧化氮合酶(eNOS)的诱导和NO的产生。
阻断MAPK和Akt通路,使NO、PGI2等血管舒张物质产生减少。
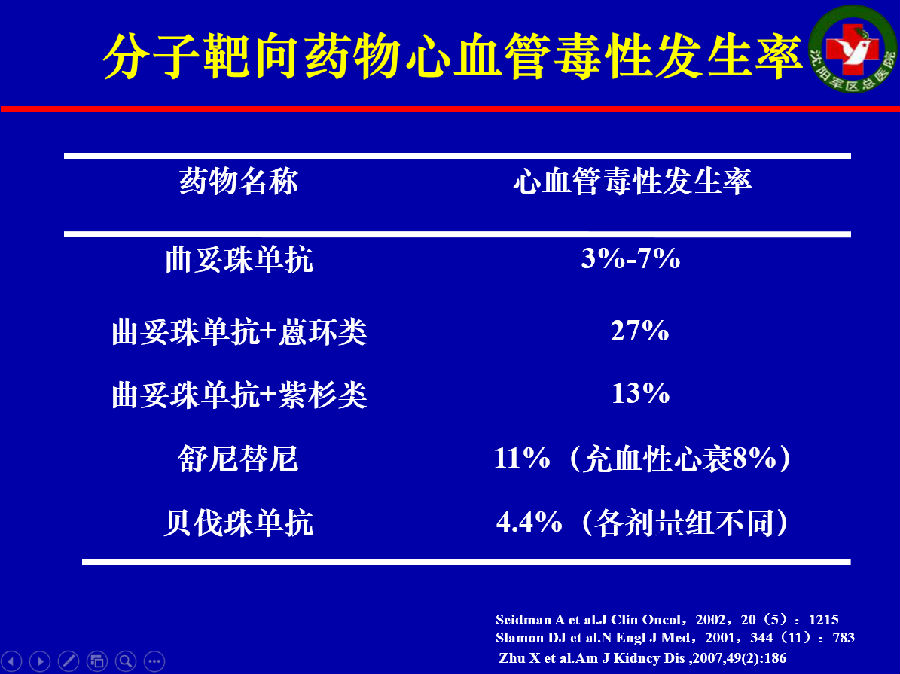
上图为分子靶向药物心血管毒性的发生率汇总。
心血管毒性的评估标准及防治原则
监测及评估
靶向药物导致心血管毒性的评估可应用NCI CTCAE 4.0作为评价标准。也可以应用CREC的标准评估是否出现曲妥珠单抗相关心脏毒性:
伴随有症状时,LVEF较基线期下降至少5%,且<55%;
不伴随症状时,LVEF较基线期下降至少10%,且<55%。
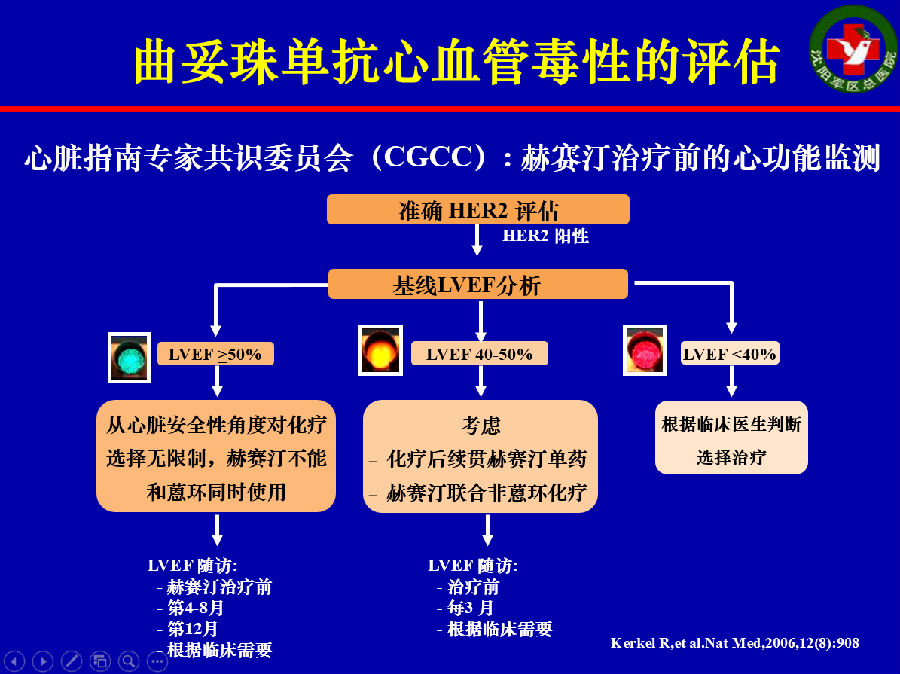
心脏指南专家共识委员会(CGCC)也对曲妥珠单抗治疗前的心功能监测、处理做出了详细规定。(上图所示为治疗前心功能监测指导诊疗的流程)
由于超声心动图使用受限,LVEF对早期心脏毒性不敏感,也可以推广多普勒成像,斑点追踪显像技术和实时三维超声心动图等技术在临床中应用。
生物标志物方面,心肌肌钙蛋白水平的测量可有效显示早期阶段药物引起的心脏损伤。 B型利尿钠肽(BNP)具有优异的排除心力衰竭的阴性预测值(<100pg / m l)。
CGCC对曲妥珠单抗治疗期间LVEF下降的评估流程见如下2图。
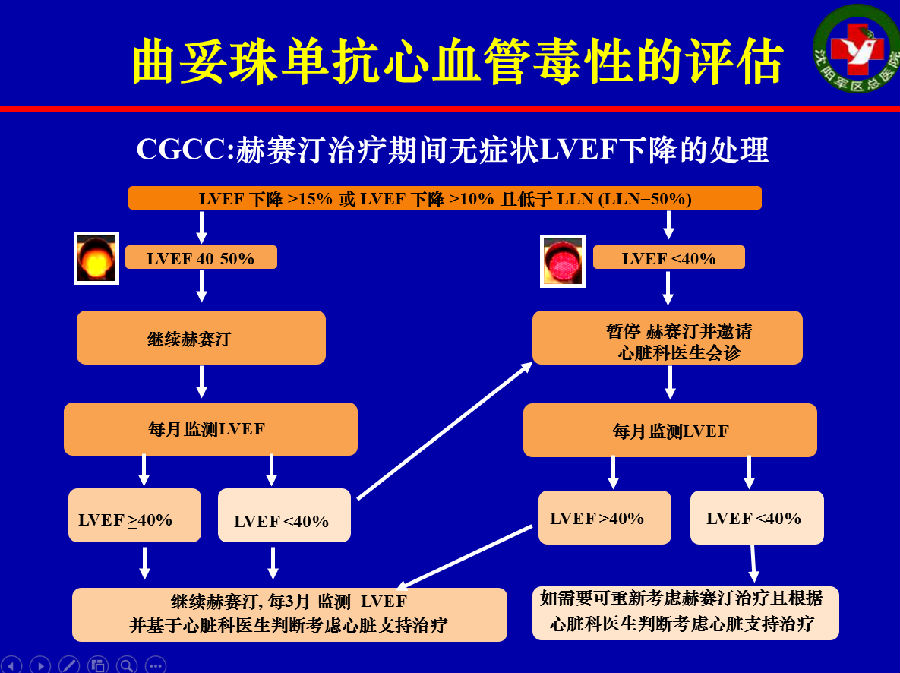
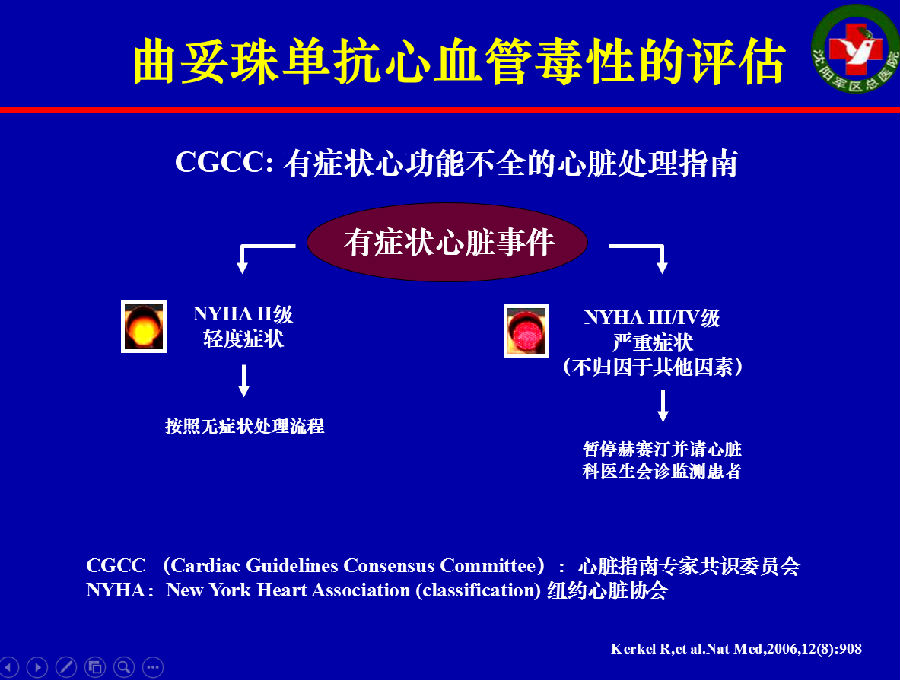
2012年ESMO上对靶向药物导致心血管毒性的监测给出了如下建议:
◆老年肿瘤:推荐60岁及以上年龄提高警惕 (IA)
◆转移性肿瘤:在初治的无症状期应频繁监测LVEF (II A)
◆接受蒽环类或曲妥珠单抗辅助治疗:在基线期,第3、6、9(治疗期)和第12、18个月(治疗后)进行心功能监测 (IA)
◆15岁前开始蒽环类治疗,或15岁后开始治疗但累积剂量阿霉素>240mg/㎡或表柔比星>360mg/㎡,推荐治疗后4年和10年分别进行心脏功能评估。(II B)
◆肌钙蛋白T和BNP浓度可用于监测心血管风险(Ⅲ B)
防治
如下是常见靶向治疗导致心血管毒性的处理方法。
曲妥珠单抗
◆美国心脏协会建议,在无症状LEVF下降中应用ACEI类或ARB类药物和B-受体阻滞剂。在有症状心衰患者合并体液潴留时加用利尿剂。
◆欧洲心脏协会和美国心力衰竭协会(HFSA)建议当患者LVEF小于40%时无论有无症状都应加用ACEI类药物。如果ACEI类药物耐药可改用ARB类药物。对于体液潴留的患者,可加用利尿剂。
贝伐珠单抗
◆使用VEGF抑制剂如贝伐珠单抗前,应测量基线血压。如血压过高,应在治疗前给予降压药物。如发生恶性高血压 (SBP > 200 mmHg ),应停治疗,进行标准降压治疗。引起高血压中位时间约为100天,每个疗程都应进行血压评价。
◆ACEI类,ARB类, B-受体阻滞剂,CCB类,利尿剂已被用于贝伐珠单抗引起的高血压治疗。应避免应用干扰细胞色素P450和CYP3A4抑制剂(如地尔硫卓,维拉帕米)等药物。
索拉非尼
Schmidinger M等研究显示:联合心血管药物后使用索拉非尼或舒尼替尼并不增加相应临床事件的发生率,因此可使用ACEI等药物控制患者高血压, 需测量基线血压,治疗前6周,应每周进行血压监测。
B-受体阻滞剂卡维地洛具有抗氧化作用,能够保护心肌细胞线粒体,可用于治疗伊马替尼相关性心血管毒性。
而对于靶向药物导致的心脏毒性,比治疗更重要的为预防策略。Moslehi JJ在2016年发表的《新英格兰医学杂志》中提出肿瘤患者适用ABCDE方案预防心血管疾病:
A阿司匹林
B控制血压
C调脂及戒烟
D控制血糖及改善饮食结构
E 适度运动及超声心动图检查
总结
2016年12月12日,ASCO在线发表了关于肿瘤导致心脏毒性的3条建议:
◆对于医务人员,在开始治疗肿瘤前就要针对心脏功能状态进行个体化评估;
◆在肿瘤治疗期间,肿瘤幸存者中对某些有较高风险的患者,可以从预防和筛查策略中获益;
◆在已接受具有潜在心血管毒性治疗的任何肿瘤幸存者中临床上应高度警惕心血管毒性,降低心血管毒性评估门槛;
2016年新英格兰杂志上发表的文章指出,尽管靶向治疗给更多肿瘤患者带来获益,但同时它所带来的心血管毒性包括血栓、高血压、心衰等应引起足够的重视,规范诊治、防治疗及护理都尚在研究和发展之中。
最后,谢晓冬教授对本次报告作出了总结:
肿瘤分子靶向药物的心血管毒性发生机制可能不同,“同病异治”、“异病同治”理论可能在此领域试用;
靶向治疗导致心血管毒性尚需多学科共同参与,组建协作机构势在必行,如MD Anderson癌症中心及欧洲肿瘤研究所均建立心脏病学单元;
靶向治疗相关心血管毒性发生率,发生机制,风险预测及评估,防治有待于进一步深入研究。
