![[ASCO50周年]胃肠道恶性肿瘤研究的创新和发现.png](http://www.medlive.cn/uploadfile/20140611/14024565641345.png)
作者简介:Dr. Shah是康奈尔大学威尔康乃尔医学院、纽约长老会医院副教授,也是JCO编委会成员。自2001年以来,他一直是美国临床肿瘤学会会员。
ASCO成立时非常低调和庄重,现在已经成为旨在提高恶性肿瘤治疗水平的国际协会。自从ASCO半个世纪以前成立以来,癌症的治疗发生了转变。该协会起源于创立会员提出的3个根本的问题:越来越多的患者患有化疗和手术不起作用的浸润性恶性肿瘤,对抗癌药物的危险性了解的加深(包括毒性反应和治疗相关性死亡),以及不知如何应用化疗来延长患者的生存期。
特别是20世纪60年代,内科肿瘤学还未成为一个专业。大家忽然意识到,化疗所造成的伤害比好处要多,以及药物本身就可能治愈癌症的观点都是滑稽可笑的。1964年,一位数学生物学家Howard Skipper博士提出了杀灭癌细胞的新理论——细胞杀伤模型,某一剂量的化疗药物可以杀伤某一比例的癌细胞。因此需要多次给予化疗药物才能杀灭每一个癌细胞。自那以后,我们看到癌症的治疗有了明显的进步,尤其是胃肠道的癌症。
结直肠癌筛查可以挽救生命
作为一种20世纪60年代出现的技术,我们安全监测结肠并摘除恶变前的息肉的能力极大的提高了结直肠癌筛查的成功率。William Wolff和Hiromi Shinya医生于1969年发明了有弹性的结肠镜,极大地提高了当时的医疗技术水平(例如钡灌肠和乙状结肠镜检查),因为该技术可以直接观察到结肠的全长并可以摘除息肉。
尽管多个研究者强烈支持进行结肠癌筛查,但是20世纪70年代中期至20世纪80年代,结肠癌筛查仍然是一个极具争议的话题,因为此时结肠癌筛查患者的生存期获益的数据才刚刚出现。然而,在20世纪90年代早期,就已经明确腺瘤性息肉(代表大约一半到2/3的结直肠息肉)可以导致结直肠癌。非常重要的是,结肠镜清除息肉后,结直肠癌的风险降低了大约75%-90%,这与息肉的特点有关。
自从20世纪90年代中期,结直肠癌的发病率下降的速度显著加快,自1998年至2005年间,男性结直肠癌的发病率每年下降2.8%,女性每年下降2.2%,这些都归功于结直肠癌筛查。尽管结肠癌筛查率从2000年的44%上升至2010年的65%,但是仍有相对一部分适合筛查的患者不知何种原因不去进行筛查。发表于2013年的一项研究显示,未进行筛查的结直肠癌患者晚期肿瘤所占的比例更高,疾病死亡率大约是进行筛查的患者的3倍。
胃肠恶性肿瘤治疗的进展
外科手术的进步
1826年,Jacques Lisfranc进行了第一例经会阴直肠癌切除术,75年以后的1899年美国直肠病协会才成立。自此,外科手术技术和术后护理技术才有了长足的进步。在直肠癌方面,外科手术技术最重要的突破是20世纪80年代出现的全直肠系膜切除术,该术式能够保存肠功能,并能够顺着适当的解剖平面进行解剖。
就单独这一手术技术的进步使患者的5年生存率由全直肠系膜切除术出现以前的45%-50%上升至(该技术出现以后的)75%,局部复发率也从30%降至5%-8%。随着腹腔镜(辅助)结肠切除术的出现(报道于1991年),此后的几十年里最值得注意的进步就是微创技术的应用率的提高。该技术在不影响肿瘤主体和远期预后的情况下,明显降低了手术并发症的发生率。
化疗的进展
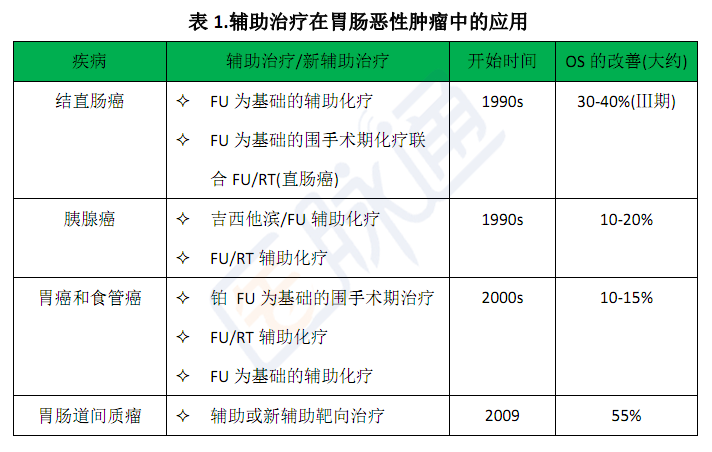
起初,大家对化疗充满了怀疑的态度,但是20世纪60年代时儿童白血病的成功治愈,现在已经成功用于治疗其他实体瘤。联合化疗方案将儿童白血病的缓解率提高到了大约60%,20世纪70年代早期,联合化疗方案首次用于治疗弥散性大B细胞淋巴瘤。随后很快出现了辅助治疗的概念,该概念认为药物治疗可以杀灭微小的转移灶,可以提高治愈率。结肠癌辅助化疗的成功首先由Moertel等人发表于1990年,结肠癌切除术后的患者治愈率提高到了33%。现在新辅助治疗和辅助治疗用于许多胃肠恶性肿瘤的患者,患者术后治愈率的提高有统计学意义。
生物治疗
尤其是在过去的25年里,我们对肿瘤生物学、致癌和肿瘤进展的重要因素的理解有了极大的提高。其中里程碑式的事件是我们意识到,癌症的发生是基因缺陷的连续累积的结果,就像早期腺瘤发展至结肠癌时所发现的基因畸变一样(例如,从APC至RAS,再到PI3K)。这一发现使我们明白,致癌作用的时间过程是论年计算的,而不是论月计算的。也就是说要经过15-20年,一开始的肿瘤畸变才能演变成为结肠癌。自从2003年,人类基因组计划完成后,我们已经对多种胃肠恶性肿瘤进行了基因测序,包括胰腺癌、结肠癌、食道癌和胆管癌,还有许多其他的恶性肿瘤的测序也即将完成。对癌症基因、家族性胃肠恶性肿瘤综合征了解的加深,以及降低风险的预防性手术的出现促进了癌症治疗的这些进展。例如,1998年我们发现CDH1原发性突变是遗传性弥漫性胃癌的发病原因,随后我们意识到携带这一突变基因的患者一生中患有遗传性弥漫性胃癌的风险大约是80%。降低风险的预防性胃切除术从2001年开始就已经开展,这一术式明显降低了该病的发病风险。
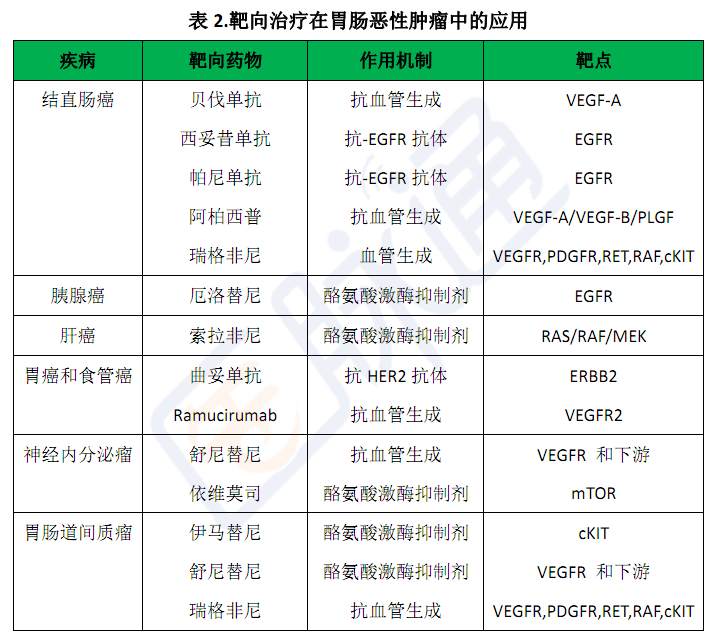
我们对癌基因理解的加深和其他里程碑式的生物发现将我们带入了胃肠恶性肿瘤靶向治疗的时代。最先广泛应用于胃肠恶性肿瘤的靶向治疗的药物是伊马替尼,该药物是一种酪氨酸激酶抑制剂,最早是用于抑制Abl激酶的,在慢性骨髓性白血病的治疗中取得了成功,但是它在对cKIT酪氨酸激酶的抑制方面也有活性。2002年,Demetri和他的同事们发布了伊马替尼在治疗胃肠道间质瘤时的疗效和安全性。胃肠道间质瘤是由cKIT驱动的,对细胞毒性治疗不敏感,以前对于不能手术切除的患者而言是致命的。应用伊马替尼治疗可以使疾病得到缓解,使超过80%的患者疾病控制时间延长,从而改变了这一疾病治疗的现状。
贝伐单抗是第二种被批准用于胃肠恶性肿瘤治疗的靶向治疗或生物治疗药物,该药与化疗联合尤其适合用于结肠癌的治疗。基于数十年来的观念,肿瘤血管形成是一个复杂的过程,涉及多方面的因素,其对于实体瘤的生长、肿瘤的增殖和血行转移都是必须的。促血管生成因子受低氧的驱动,是由多种胃肠恶性肿瘤释放的。肿瘤的血管生成受血管内皮生长因子的控制,其受体促进了用于胃肠肿瘤治疗的多种抗体抑制剂的产生,用于治疗结直肠癌的贝伐单抗、阿柏西普和瑞格非尼以及用于治疗胃癌和胃食管恶性肿瘤的ramucirumab都是极好的例子。
肝细胞癌治疗的突破始于1981年乙肝疫苗的研制,这是首个预防癌症的疫苗。从那以后肝细胞癌的治疗有了明显的改变,包括肝移植、切除、动脉栓塞±化疗以及射频消融术。肝细胞癌的抗肿瘤治疗药物很少,一个III期试验显示,与不治疗的患者相比,口服的酪氨酸激酶抑制剂索拉非尼能够延长患者的生存期,该发现明显提高了肝细胞癌的治疗水平。
表皮生长因子受体抑制剂家族的发展也改变了我们对多种胃肠恶性肿瘤的治疗方式。配体结合EGFR导致受体磷酸化,并促进了癌细胞增殖、侵犯和生存等多种细胞信号通路的激活。西妥昔单抗(2004年批准使用)和帕尼单抗(2006年批准使用)是EGFR单克隆抗体,能够阻断配体结合和激活。这种新药提高了结直肠癌患者的生存期。随后发现,KRAS突变与对这种治疗的抗药性有关。最近出现的“all-RAS”分析能够预测对EGFR抗体抑制剂的抗药性。
在胃癌的治疗方面,里程碑式的TOGA试验评估了曲妥单抗+化疗治疗HER2阳性胃癌的疗效。这是值得注意的,不仅仅因为这是批准用于治疗该病的首个生物治疗药物,还因为有证据表明靶向抑制剂不能直接由一种疾病转换到治疗其他疾病中去。乳腺癌和胃癌中HER2阳性的定义不同,胃癌治疗时曲妥单抗的最佳剂量也与乳腺癌的最佳剂量不同(目前NCI01450696试验正在研究)。
总结和展望
我们看到,过去半个世纪胃肠恶性肿瘤的治疗的进展是多层面的。鉴于进展如此多种多样,我相信,癌症治疗的所有方面的主旋律都是创新。ASCO的未来的特点也将是创新和发现。我们进入了精密治疗的时代,我们根据每位患者肿瘤的基因档案进行个性化治疗,而不必追究其原发灶。免疫调节治疗最近显示出极大的希望。我们在成像和疾病监测方面已经取得了极大的进步。
但是随着技术的持续进步,新的成像模式将改变我们看待和治疗肿瘤的方式。我们也开始理解癌症和肿瘤干细胞的起源,也知道这些癌症起始细胞是多么不堪一击。这些进展终将转化为我们对恶性肿瘤的治疗,但是也需要明智的试验设计和应用。我们意识到社会对恶性肿瘤的治疗资金是有限的,我们需要在患者的疗效和成本最优方面(最优性价比)做出艰难的选择。有人告诉我,ASCO也将为此努力。
编译自:Innovation and Discovery in Gastrointestinal Malignancy Research 1964-2014.ASCO DAILY NEWS,mAY 31,2014.
医脉通整理报道,转载请注明出处。
会议专题》》》2014年ASCO年会专题报道
